Oddziaływania międzycząsteczkowe dzieli się na:
-siły van der Waalsa
-przeniesienie ładunku
-wiązania wodorowe
Siły van der Waalsa
Pierwszy typ oddziaływań - siły van der Waalsa - został zasugerowany przez holenderskiego fizyka, od nazwiska którego pochodzi ich nazwa, na podstawie badania zachowania się gazów niedoskonałych. W ujęciu mechaniki kwantowej siły te można podzielić na trzy rodzaje:
-oddziaływanie dipol-dipol
-przyciąganie dipol-dipol indukowany
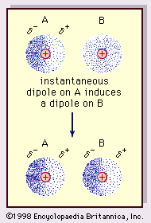
-oddziaływanie dipol chwilowy- dipol indukowany
Sens fizyczny oddziaływań dipol-dipol i dipol-dipol indukowany można wyrazić następująco. Dwie cząsteczki mające momenty dipolowe mogą przyjąć takie wzajemne położenie, że dodatni ładunek dipola jednej cząsteczki zbliży się do ujemnego ładunku dipola innej cząsteczki. W wyniku takiej orientacji nastąpi przyciąganie cząsteczek. Przyciąganie typu dipol-dipol indukowany wynika z polaryzacji niepolarnej cząsteczki w polu elektrycznym cząsteczki dipolowej co prowadzi do przyciągania obu cząsteczek.
Oddziaływanie dipol chwilowy- dipol indukowany jest wywołane przez ciągłą fluktuację ładunku w cząsteczce czy atomie. Takie ciągłe zmiany rozkładu ładunku powodują powstawanie chwilowych momentów dipolowych, które mogą powodować przyciąganie innych cząsteczek zgodnie z mechanizmem dipol-dipol indukowany. Zjawisko to występuje np. w gazach szlachetnych umożliwiając ich skraplanie i tłumacząc wzrost temperatury wrzenia tych gazów wraz ze wzrostem ich liczby atomowej (oddziaływanie to jest tym większe im większa jest liczba elektronów w rozważanej cząsteczce czy atomie i im łatwiej są one polaryzowalne). Przyciąganie wynikające z tej przyczyny określa się jako siłę dyspersyjną Londona; oddziaływanie to jest słabe zmieniające się z odwrotnością odległości pomiędzy jądrami w szóstej potędze. Oddziaływani dyspersyjne odgrywają dużą rolę w enzymach. Enzym zawiera pewne niepolarne ale polaryzowalne grupy tzw. kieszenie, które stanowią pułapkę dla niepolarnych lecz polaryzowalnych grup jak fragmenty łańcuchów węglowych ale nie przyciągają cząsteczek polarnych jak woda.
Kompleksy z przeniesieniem ładunku.
Kompleks na przykładzie fenolu i chinonu
Znane są związki, w których dwie cząsteczki wykazują słabe wzajemne przyciąganie, ale jest ono silniejsze niż siły van der Waalsa i słabsze niż wiązanie wodorowe. Układy takie nazywa się kompleksami z przeniesieniem ładunku, gdyż następuje w nich przeniesienie ładunku z jednego układu do drugiego. Stan taki odpowiada utworzeniu bardzo słabo wiążącego orbitalu cząsteczkowego, w którym niewielki udział orbitalu akceptora jest domieszany do funkcji falowej orbitalu donora. Oddziaływania tego typu są zazwyczaj tak słabe, że nie daje się wyizolować czystego związku kompleksowego. Jako przykład może posłużyć tu cząsteczkowy jod rozpuszczony w benzenie.
Wiązanie wodorowe

Badając wiele związków chemicznych tak w stanie stałym jak i cieczy czy pary stwierdzono, że wodór jest przykoordynowany do dwóch atomów, przy czym chemicznie związany jest z jednym atomem ale w stosunku do drugiego jest położony znacznie bliżej niż wynikało by to z sumowania promieni van der Waalsa. Wiązanie takie można przedstawić następująco A-H.....B, przy czym odległości A-H i H-B są z reguły różne (wyjątkiem jest F-H-F). Wiązanie to powstaje gdy pierwiastkami A i B są: C, N, O, P, F, S, Cl, Se, Br, I. Rozpatrując to wiązanie trzeba uwzględnić cztery czynniki:
1. Przyciąganie elektrostatyczne - gdy atom A jest bardziej elektroujemny niż wodór, to nastąpi polaryzacja wiązania A-H i atom A będzie miał ładunek ujemny, a wodór dodatni. Teraz jeżeli elektroujemny atom B ma ładunek ujemny to nastąpi przyciąganie pomiędzy nim a wodorem.
2. Elektrostatyczne odpychanie - zachodzi głównie pomiędzy atomami A i B ponieważ wodór nie ma rdzenia atomowego. Atomy A i B mogą mieć ładunki ujemne.
3. Przeniesienie ładunku - atom B może zachować się jako donor elektronów do grupy A-H, w wyniku czego powstanie kompleks z przeniesieniem ładunku.
4. Siły dyspersyjne Londona - będą dawały niewielki dodatni wkład do mocy wiązania A-H.....B.
Najbardziej oczywistym przejawem występowania wiązania wodorowego jest podwyższenie temperatury wrzenia związków.
Ciała stałe
(w postaci krystalicznej i bezpostaciowej) wykazują bardzo małą ściśliwość. Cząsteczki są w nich umieszczone bardzo blisko siebie i wskutek oddziaływania znacznych sił międzycząsteczkowych, ściśle ze sobą związane bez możliwości swobodnego poruszania się. W wyniku tego przeciwstawiają się one zmianom kształtu i wykazują sprężystość postaci. Siły międzycząsteczkowe, które przy zwiększaniu odległości między cząsteczkami są siłami przyciągania, a przy zmniejszaniu - siłami odpychania, powodują, że ruch cząsteczek jest nieustannie trwały j całkowicie bezwładny. Objawia się to w wykonywaniu drgań we wszystkich kierunkach.
Przeprowadzane badania wykazały, że średnia energia kinetyczna materii jest tym większa, im wyższa jest temperatura bezwzględna ciała. Nosi to nazwę ruchu cieplnego.
Suma energii kinetycznej ruchu cieplnego cząsteczek i energii potencjalnej ich wiązania jest miarą energii wewnętrznej ciała.
Ze względu na olbrzymią liczbę cząsteczek i różnorodność ich stanu energetycznego nie można zmierzyć całkowitej energii wewnętrznej.
W miarę wzrostu temperatury ciała stałego wzrasta jego energia, a więc i amplituda ruchu drgającego cząsteczek. W związku z tym zwiększa się średnie wychylenie od położenia równowagi, powodując odpowiednie zwiększenie wymiarów ciała. Po osiągnięciu temperatury topnienia odległości między cząsteczkami ciała stałego wzrastają tak znacznie, a działające między nimi siły tak słabną, że następuje zburzenie sieci przestrzennej i staje się możliwa wzajemna zmiana położenia cząsteczek. Proces ten nazywamy topnieniem.
Ciecze

Siły wzajemnego oddziaływania cząsteczek we wnętrzu i na powierzchni cieczy
Siła wypadkowa działająca na cząsteczki położone na powierzchni jest skierowana w głąb cieczy i działa prostopadle do jej powierzchni i usiłuje zmniejszyć swobodną powierzchnię cieczy. Ciecz dąży zatem do zmniejszenia liczby cząsteczek na swojej powierzchni, a więc do osiągnięcia możliwie najmniejszej swobodnej powierzchni.
Chcąc zwiększyć swobodną powierzchnię cieczy, trzeba wykonać pewną pracę na pokonanie napięcia powierzchniowego.
r = W/S (J/m2)
Gazy
stanowią postać materii dość precyzyjnie dającą się opisywać różnymi ogólnymi prawami. Odstępstwa od ogólnych praw wywoływane są najczęściej przez oddziaływania międzycząsteczkowe, które w gazach są przeważnie tak nikłe, że możemy je zaniedbywać. Gazy rzeczywiste, spotykane w przyrodzie najczęściej spełniają dość dobrze większość praw ustalonych dla gazów idealnych, czyli takich w których międzycząsteczkowe oddziaływania nie występują. Ponieważ w gazach rzeczywistych są one nikłe, ale są, gazy rzeczywiste zaczynają odbiegać swoimi właściwościami od praw gazowych w miarę jak rosnące ciśnienie i malejąca temperatura przybliża je do stanu przejścia w ciecz (skroplenie). Zarówno jeden jak i drugi czynnik powoduje zbliżenie się cząsteczek gazu do siebie, a co za tym idzie, wzrost oddziaływań sił międzycząsteczkowych (van der Waalsa) do rozmiarów, których już zaniedbać nie można.
Podstawowe prawa gazu doskonałego można zapisać w postaci:
p·V = n·R·T
gdzie: p - ciśnienie, V - objętość, n - ilość moli gazu, R - stała gazowa, T - temperatura w kelwinach.
Podsumowanie
W gazach występują największe
odległości między cząsteczkami, dlatego oddziaływanie między
nimi jest najmniejsze. Łatwo zmienić ich kształt i objętość,
przyjmują kształt naczynia, w którym się znajdują oraz
wypełniają całą dostępną im przestrzeń.
W cieczach odległości między cząsteczkami są większe niż w ciałach stałych, ale mniejsze niż w gazach. Podobnie jak gazy przyjmują kształt naczynia, w którym się znajdują. Trudno zmienić ich objętość.
W ciałach stałych poprzez najmniejsze odległości między cząsteczkami występują największe oddziaływania między nimi. Trudno zmienić ich objętość i kształt (wysoka temperatura może prowadzić do uplastycznienia ciała).
W cieczach odległości między cząsteczkami są większe niż w ciałach stałych, ale mniejsze niż w gazach. Podobnie jak gazy przyjmują kształt naczynia, w którym się znajdują. Trudno zmienić ich objętość.
W ciałach stałych poprzez najmniejsze odległości między cząsteczkami występują największe oddziaływania między nimi. Trudno zmienić ich objętość i kształt (wysoka temperatura może prowadzić do uplastycznienia ciała).

Brak komentarzy:
Prześlij komentarz